近期干細(xì)胞研究進(jìn)展匯總!
1.Science:激活溶酶體可讓衰老的神經(jīng)干細(xì)胞恢復(fù)青春
在一項新的研究中,來自美國斯坦福大學(xué)醫(yī)學(xué)院的研究人員發(fā)現(xiàn)在小鼠大腦中,年輕的靜止性神經(jīng)干細(xì)胞(resting neural stem cell)在它們的溶酶體(細(xì)胞中的一種特定的細(xì)胞器,用于處理細(xì)胞垃圾)中儲存著大量的蛋白聚集物。相 關(guān)研究結(jié)果發(fā)表在2018年3月16日的Science期刊上,論文標(biāo)題為“Lysosome activation clears aggregates and enhances quiescent neural stem cell activation during aging”。論文通信作者為斯坦福大學(xué)老化生物學(xué)中心副主任Anne Brunet,論文第一作者為博 士后研究員Dena Leeman博士。 這些研究人員先是觀察靜止性神經(jīng)干細(xì)胞的基因表達(dá)譜與那些對觸發(fā)新的神經(jīng)元產(chǎn)生的外部信號作出反應(yīng)的活化神經(jīng)干細(xì)胞(activated neural stem cell)的基因表達(dá)譜之間可能存在的差異。他們比較了當(dāng)它們衰老時,它們?nèi)绾巫鞒龈淖儭?/p>
Leeman從來自年輕小鼠和老年小鼠的大腦中分離出幾種細(xì)胞群體進(jìn)行研究,包括靜止性神經(jīng)干細(xì)胞、活化神經(jīng)干細(xì)胞和由活化神經(jīng)干細(xì)胞產(chǎn)生的神經(jīng)祖細(xì)胞。她發(fā)現(xiàn)靜止性神經(jīng)干細(xì)胞表達(dá)許多與溶酶體相關(guān)的基因,而活化神經(jīng)干細(xì)胞表達(dá)與一種參與蛋白破壞的蛋白復(fù)合 物(被稱作蛋白酶體)相關(guān)的基因。嚴(yán)格控制蛋白產(chǎn)生和清除可讓細(xì)胞維持必需的蛋白庫存來以執(zhí)行所需的細(xì)胞功能。
當(dāng)Leeman利用一種結(jié)合到蛋白聚集物上的染料對年輕的靜止性神經(jīng)干細(xì)胞和活化神經(jīng)干細(xì)胞進(jìn)行染色時,她吃驚地發(fā)現(xiàn)靜止性神經(jīng)干細(xì)胞經(jīng)染色后變得更加明亮,不過它們具有較低的蛋白產(chǎn)生率。Leeman還發(fā)現(xiàn),相比于活化神經(jīng)干細(xì)胞,年輕的靜止性神經(jīng)干細(xì)胞在它們 的溶酶體中相對較慢地堆積這些蛋白聚集物。
2.JCI:上海交大醫(yī)學(xué)院發(fā)現(xiàn)清除白血病干細(xì)胞的潛在新靶點
白血病干細(xì)胞是與白血病發(fā)生、發(fā)展和復(fù)發(fā)有關(guān)的一群細(xì)胞,在白血病干細(xì)胞上發(fā)現(xiàn)新的治療靶點對于徹底治愈白血病有至關(guān)重要的意義。最近來自上海交通大學(xué)醫(yī)學(xué)院的鄭俊克和陳國強院士等人在白血病干細(xì)胞上發(fā)現(xiàn)了一個高表達(dá)的基因,并揭示了該基因參與白血病發(fā)生的重要機(jī)制。相關(guān)研究結(jié)果發(fā)表在國際學(xué)術(shù)期刊JCI上。
在這篇報道中,研究人員發(fā)現(xiàn)JAM3(junctional adhesion molecular 3)在小鼠和人的白血病干細(xì)胞中高水平表達(dá),在MLL-AF9誘導(dǎo)的小鼠急性髓系白血病模型的系列移植過程中清除Jam3能夠幾乎完全阻止白血病的發(fā)生過程。相比之下,jam3缺失并不會影響小鼠造血干細(xì)胞的功能。
除此之外,研究人員還發(fā)現(xiàn)敲低JAM3會導(dǎo)致人白血病細(xì)胞系和原代白血病干細(xì)胞的增殖受到抑制。機(jī)制研究表明JAM3能夠直接與LRP5發(fā)生相互作用激活下游的PDK1/AKT信號途徑,隨后GSK3β發(fā)生下調(diào),β-catenin/CCND1信號途徑發(fā)生激活,以維持白血病干細(xì)胞的自我更新能力和進(jìn)入細(xì)胞周期的能力。
3.Science:揭示動物組織再生藍(lán)圖
在一項新的研究中,來自美國懷特海德研究所的研究人員描述了一種關(guān)于真渦蟲(planarian)眼睛再生的模型:真渦蟲的眼睛再生受到同時發(fā)揮作用的三個原則的調(diào)控,這有助了解真渦蟲的祖細(xì)胞如何在再生中發(fā)揮功能。這種模型涉及位置線索;吸引祖細(xì)胞到現(xiàn)存結(jié)構(gòu)的自組織(self-organization);起源自分散的空間區(qū)域而不是起源自精確位置的祖細(xì)胞,從而給它們的遷移路徑提供靈活性。這三個原則似乎確定著祖細(xì)胞在再生期間如何決定遷移到何處進(jìn)行形態(tài)和功能重建,并且它們讓我們從系統(tǒng)水平上理解這個過程更接近一步。相關(guān)研究結(jié)果于2018年3月15日在線發(fā)表在Science期刊上,論文標(biāo)題為“Self-organization and progenitor targeting generate stable patterns in planarian regeneration”。論文通信作者為懷特海德研究所研究院、麻省理工學(xué)院生物學(xué)教授和霍華德休斯醫(yī)學(xué)研究所研究員Peter Reddien博士。
Reddien和他的實驗室花了十多年的時間利用一種被稱作真渦蟲的小扁蟲來揭示再生之謎。如果一個真渦蟲的頭部被截斷,或者它的一側(cè)被切除,那么它的每一部分(比如它的被截斷的頭部和剩余的部分)都會再生出整個動物。為了理解祖細(xì)胞在動物再生的嘈雜環(huán)境中如何決定遷移到哪里,這些研究人員使用了真渦蟲的眼睛,它是一個肉眼看得見的器官,該器官足夠小以至于可在不會產(chǎn)生嚴(yán)重?fù)p傷的情況下將它切除,此外,它還含有人們已確定的祖細(xì)胞分子標(biāo)志物。
這些研究人員設(shè)計了一個簡單的實驗來解決這些祖細(xì)胞如何決定遷移到哪里的問題:截斷真渦蟲的頭部,接著在三天后從這個被截斷的頭部部分移除一只眼睛。他們發(fā)現(xiàn)祖細(xì)胞會在位于剩余的一只眼睛的前面開始形成一只新的眼睛,而不是在解剖結(jié)構(gòu)確定的“正確”位置(與剩余的這只眼睛相對稱的位置)上形成一只新的眼睛。但是,如果在更早的時候---與頭部截斷的同一天而不是在三天后---從被截斷的頭部部分移除一只眼睛,然后開展相同的實驗,那么會產(chǎn)生不同的結(jié)果:新的眼睛在與剩下的一只眼睛相對稱的位置---也就是身體結(jié)構(gòu)的“正確”位置---上開始形成,這提示著當(dāng)多種選擇存在沖突時,解剖結(jié)構(gòu)的自組裝動力學(xué)取勝。
這些簡單的規(guī)則指導(dǎo)這種動物成功再生,并且當(dāng)它的再生潛能被最大限度地挖掘時會產(chǎn)生替代性的穩(wěn)定的解剖結(jié)構(gòu)形態(tài):產(chǎn)生具有三只眼睛、四只眼睛或五只眼睛的真渦蟲。切除這種動物的一側(cè)并且截斷它的頭部能夠讓它的祖細(xì)胞足夠遠(yuǎn)地遠(yuǎn)離現(xiàn)有的眼睛,從而允許在頭部部分中開始形成第三只眼睛。
4.Nat Biotechnol:干細(xì)胞療法治療黃斑退化
2015年6月, 86歲的Douglas Waters出現(xiàn)了嚴(yán)重的老年性黃斑變性癥狀(AMD),導(dǎo)致難以看清東西。幾個月之后,他成為了UC Santa Barbara的研究者開發(fā)的利用干細(xì)胞誘導(dǎo)分化的視覺細(xì)胞治療AMD的臨床試驗的一員。在手術(shù)之前,Douglas的視力很差,右眼幾乎看不到任何東西。而手術(shù)之后,他的視力恢復(fù)地很快,能夠閱讀報紙以及干一些農(nóng)活。這項出色的臨床治療結(jié)果發(fā)表在最近一期的《Nature Biotechnology》雜志上,該文章描述了將從干細(xì)胞誘導(dǎo)而來的,工程化的視網(wǎng)膜色素上皮細(xì)胞移植進(jìn)入患者的眼睛中,從而幫助AMD患者重建光明。結(jié)果表明該方法具有安全性以及有效性。
黃斑變性是發(fā)達(dá)國家中造成50歲以上人群視力損傷的主要原因。該疾病的發(fā)生主要是由于血管病變導(dǎo)致血液難以進(jìn)入視網(wǎng)膜的中心黃斑區(qū)域。在這項研究中,作者希望能夠使用干細(xì)胞將患者眼部后側(cè)受損的細(xì)胞置換,從而恢復(fù)患者的視力。該手術(shù)總共耗時大概1到2小時。除了Douglas之外,該試驗中還有一名60歲的女性患者。在手術(shù)后的12個月內(nèi),她與Douglas兩人的視力恢復(fù)水平都十分顯著。此前他們都幾乎無法閱讀,而手術(shù)之后則能夠在佩戴正常眼鏡的情況下每分鐘閱讀60-80個字。
5.干細(xì)胞療法能夠修復(fù)更年期的過早出現(xiàn)以及生育問題
新聞來源:Stem cell therapy may help reverse effects of premature menopause, restore fertility
最近一項臨床研究指出,通過自體骨髓移植的手段能夠使因卵巢功能早衰而生育力下降的女性重新恢復(fù)生育能力,而且避免過早地進(jìn)入更年期。相關(guān)結(jié)果在最近于芝加哥召開的第100屆內(nèi)分泌學(xué)會年度會議上得到了展示。
"在接受治療的兩名受體中,我們發(fā)現(xiàn)其血清雌激素水平在接受干細(xì)胞移植后的三個月后出現(xiàn)了明顯升高,而且該效應(yīng)能夠持續(xù)一年之久。患者的更年期癥狀得到了緩解。干細(xì)胞移植六個月后其經(jīng)期得到了重新恢復(fù)"。該研究的高級作者,來自伊利諾伊斯大學(xué)的教授Ayman Al-Hendy說道。
研究者們計劃招募33名參與者進(jìn)行臨床試驗,在目前已經(jīng)接受治療的兩名患者中,他們從每名患者的髂嵴處提取了間葉干細(xì)胞并且通過微創(chuàng)腹腔鏡的手段將細(xì)胞注入自身一側(cè)卵巢中,同時保證另外一側(cè)卵巢不受影響。之后,研究者們定期對患者的血常規(guī)、卵巢成像以及更年期癥狀進(jìn)行調(diào)查。
由于研究者們發(fā)現(xiàn)接受治療的女性其雌激素水平有明顯上升,而且開始出現(xiàn)經(jīng)期反應(yīng)。因此,研究者們希望能夠進(jìn)一步恢復(fù)患者的生育能力。
6.Nat Med:首次證實人神經(jīng)干細(xì)胞移植可改善脊髓損傷猴子的抓力
在一項新的研究中,研究人員報道移植到猴子受損脊髓中的人神經(jīng)干細(xì)胞成熟為神經(jīng)元,觸發(fā)神經(jīng)連接形成,從而讓這些猴子抓住橙子的能力得到改善。相關(guān)研究結(jié)果近期發(fā)表在Nature Medicine期刊上,論文標(biāo)題為“Restorative effects of human neural stem cell grafts on the primate spinal cord”。
在這項研究中,Tuszynski和他的同事們切掉獼猴的一段脊髓,然后在兩周后將人神經(jīng)祖細(xì)胞(neural progenitor cell)移植到這種脊髓損傷部位。在首批4只猴子中,這些細(xì)胞移植物沒有保持在原位,這一發(fā)現(xiàn)迫使這些研究人員將更多的纖維蛋白原-凝血酶(fibrinogen–thrombin)添加到這些細(xì)胞移植物中。纖維蛋白原-凝血酶是一種蛋白-酶混合物,可讓這些移植物更快地附著到損傷位點上。Tuszynski團(tuán)隊還不得不讓手術(shù)臺傾斜以便排出腦脊液,這是因為腦脊液會將這些移植物沖走。
經(jīng)過這些調(diào)整后,在剩余的5只猴子中,這些移植的神經(jīng)干細(xì)胞保留在原位,而且這些研究人員觀察到這些移植的干細(xì)胞發(fā)育成神經(jīng)元和神經(jīng)膠質(zhì)細(xì)胞。在損傷部位中,這些人神經(jīng)元產(chǎn)生高達(dá)15萬個線狀軸突,這些軸突從移植位點處向外延伸高達(dá)50毫米,并且早在這些新產(chǎn)生的神經(jīng)細(xì)胞就位兩個月后,這些研究人員就能夠觀察到它們與猴子本身的神經(jīng)細(xì)胞建立神經(jīng)連接。在大多數(shù)情況下,細(xì)胞移植物附著在脊髓損傷部位的猴子能夠更好地操縱它們的手指,使它們的手指繞著橙子彎曲,而細(xì)胞移植物未附著的猴子并不能握住橙子,它們的手指保持折疊,因此橙子停留在它們的指關(guān)節(jié)上。
7.Nature:揭示SMAD2/3協(xié)調(diào)人多能性干細(xì)胞發(fā)育
為了讓細(xì)胞和組織正常地發(fā)揮功能,某些基因需要在正確的時間開啟和關(guān)閉,以響應(yīng)來自細(xì)胞外的生長因子信號。已知SMAD2和SMAD3(SMAD2/3)蛋白是這個細(xì)胞信號轉(zhuǎn)導(dǎo)過程的一個重要的組成部分,在細(xì)胞內(nèi)部被激活,開啟和關(guān)閉許多不同過程(從胚胎發(fā)育和生長到激活免疫系統(tǒng)或癌癥)所需的基因。
在一項新的研究中,來自英國劍橋大學(xué)的研究人員研究了人多能性干細(xì)胞---能夠產(chǎn)生人體所有組織和器官的細(xì)胞---中的SMAD2/3與其他蛋白之間的相互作用。他們發(fā)現(xiàn)盡管SMAD2/3確實結(jié)合一些轉(zhuǎn)錄因子,但是它們也與參與細(xì)胞中的一系列分子過程的蛋白發(fā)生相互作用,從而協(xié)調(diào)這些蛋白進(jìn)行細(xì)胞信號轉(zhuǎn)導(dǎo)。相關(guān)研究結(jié)果發(fā)表在2018年3月8日的Nature期刊上,論文標(biāo)題為“The SMAD2/3 interactome reveals that TGFβ controls m6A mRNA methylation in pluripotency”。
這些研究人員首次觀察到SMAD2/3能夠激活經(jīng)過RNA編輯的蛋白,從而使得特定的mRNA變得不穩(wěn)定和快速地降解。SMAD2/3發(fā)揮的作用是將細(xì)胞信號轉(zhuǎn)導(dǎo)與RNA編輯相關(guān)聯(lián)在一起,從而允許細(xì)胞開啟和隨后再次關(guān)閉對發(fā)育至關(guān)重要的基因。鑒于SMAD2/3的活性受到生長因子的調(diào)節(jié),這項研究闡明了胞外信號能夠控制細(xì)胞功能的一種新方式。
8.Nat Protocol:科學(xué)家們培育出人類心臟3D模型

心臟是胚胎期第一個發(fā)育的器官,同時也是引發(fā)家長們顧慮的第一個器官。對于準(zhǔn)媽媽們來說,懷孕的喜悅往往會被接受醫(yī)生檢查的不安感所掩蓋。家長們與醫(yī)生們往往要考慮母親的健康以及接受藥物治療后會對胎兒可能產(chǎn)生的影響。美國FDA要求所有藥物必須注明對孕婦以及嬰兒可能產(chǎn)生的威脅。一些藥物標(biāo)簽上注明了其在動物水平的檢測中沒有發(fā)現(xiàn)致病風(fēng)險,但還沒有在孕婦群體中進(jìn)行仔細(xì)的研究。
Ma等人一直致力于研究人源誘導(dǎo)多能性干細(xì)胞(ips)技術(shù)在組織再生以及干細(xì)胞工程方面的應(yīng)用。“這類干細(xì)胞能夠分化形成機(jī)體的任何類型的細(xì)胞”。多能性干細(xì)胞能夠再生形成心臟組織,但Ma等人相信他們能夠走得更進(jìn)一步。
作者等人基于生物材料以及干細(xì)胞技術(shù),建立了心臟的3D組織模型,該模型能夠模擬人類心臟的早期發(fā)育階段。通過在組織培養(yǎng)皿中加入一層多聚物,以及在其表面蝕刻形成微小的痕跡。范細(xì)胞能夠與上述痕跡牢固地結(jié)合。由于干細(xì)胞本身并不會粘附在多聚物上,因此他們能夠沿著蝕刻痕跡生長,并最終發(fā)育形成3D結(jié)構(gòu)。作者等人的研究重點在于心臟組織,但其它實驗室也可以利用上述技術(shù)建立其它組織以及器官。相關(guān)結(jié)果發(fā)表在最近一期的《Nature Protocol》雜志上。
9.Sci Transl Med:重磅!利用牙齦中的間充質(zhì)干細(xì)胞來加速傷口愈合!
我們常常會注意到口腔內(nèi)的傷口愈合速度會比其它部位的傷口愈合速度要快,牙齦組織的修復(fù)速度大約是皮膚損傷修復(fù)速度的兩倍,而且其還能減少疤痕的形成,其中一個原因或許就是牙齦間充質(zhì)干細(xì)胞(gingival mesenchymal stem cells,GMSCs),其能夠產(chǎn)生多種類型的細(xì)胞;近日,一項刊登于國際雜志Science Translational Medicine上的研究報告中,來自賓夕法尼亞大學(xué)的科學(xué)家就通過研究闡明了牙齦間充質(zhì)干細(xì)胞加速組織修復(fù)的新型分子機(jī)制。
早期研究中,研究人員發(fā)現(xiàn),間充質(zhì)干細(xì)胞能夠通過在胞外囊泡中釋放信號分子來發(fā)揮多種功能,因此,理解如何有效區(qū)分牙齦組織和皮膚組織中間充質(zhì)干細(xì)胞非常重要,這項研究中,研究人員對來自牙齦和皮膚中的間充質(zhì)干細(xì)胞的功能進(jìn)行了對比,他們發(fā)現(xiàn),GMSCs包含多種蛋白質(zhì),包括炎癥抑制因子IL-1RA,其能夠阻斷促炎性細(xì)胞因子的釋放,同時IL-1RA還能被用作治療風(fēng)濕性關(guān)節(jié)炎的新型療法。
隨后研究人員重點尋找了到底是什么能夠控制IL-1RA和其它細(xì)胞因子的釋放,研究者推測這或許是Fas蛋白誘發(fā)的,因為該蛋白與機(jī)體的免疫調(diào)節(jié)存在一定關(guān)聯(lián);相比皮膚中的間充質(zhì)干細(xì)胞而言,牙齦中的間充質(zhì)干細(xì)胞含有更多的Fas蛋白,而且缺失Fas的小鼠機(jī)體中IL-1RA的水平也較低,其所釋放的物質(zhì)水平也會下降。隨后的分子探針研究結(jié)果表明,F(xiàn)as能夠形成Fap-1和Cav-1的蛋白復(fù)合體來誘發(fā)小型胞外囊泡的釋放,為了鑒別出這與傷口愈合的關(guān)聯(lián),研究人員對傷口組織進(jìn)行了檢測,他們發(fā)現(xiàn),IL-1RA在傷口周圍的GMSCs中水平會增加,而缺失IL-1RA的小鼠的牙齦愈合速度也會明顯減慢。
相比較而言,當(dāng)研究人員從GMSCs分離IL-1RA后,并將其注射到創(chuàng)傷部位時,明顯加速了傷口的愈合速度。研究者Kou說道,我們發(fā)現(xiàn),間充質(zhì)干細(xì)胞,尤其是牙齦中的間充質(zhì)干細(xì)胞能夠通過胞外囊泡釋放大量的細(xì)胞因子;相關(guān)研究發(fā)現(xiàn)或許對于糖尿病患者具有明顯的治療意義,研究者指出,相比健康小鼠的GMSCs而言,糖尿病小鼠機(jī)體中GMSCs或許并不太會分泌胞外囊泡,而且其GMSCs中也存在較低水平的IL-1RA分泌,引入健康小鼠機(jī)體中GMSCs所釋放的胞外囊泡就能夠降低糖尿病小鼠的愈合時間。
10.Glia:神經(jīng)干細(xì)胞再生的機(jī)制
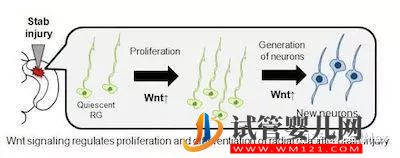
最近,來自Waseda大學(xué)的研究者們以成年斑馬魚為對象,通過建立視頂蓋穿刺損傷模型,發(fā)現(xiàn)了神經(jīng)干細(xì)胞再生的機(jī)制。該發(fā)現(xiàn)或許有助于人類中樞神經(jīng)系統(tǒng)損傷的治療。相關(guān)結(jié)果發(fā)表在最近一期的《GLIA》雜志上。
“與哺乳動物不同,斑馬魚擁有超強的神經(jīng)元再生功能,因此在大腦受到損傷后能夠快速激發(fā)腦組織再生過程。然而,它們的基因與人以及小鼠卻無太大差異”。該研究的作者,來自Waseda大學(xué)分子神經(jīng)學(xué)系的教授Toshio Ohshima說道:“此前有研究表明斑馬魚的神經(jīng)元再生功能能夠應(yīng)用于小鼠,因此或許人類也擁有相似的潛力”。
在正常情況下,大部分放射狀膠質(zhì)細(xì)胞(RG)都處于靜息狀態(tài),既不會增殖也不會分化。然而,當(dāng)研究者們給斑馬魚的大腦進(jìn)行針刺時,免疫熒光檢測結(jié)果則表明RG發(fā)生分化現(xiàn)象,而且在第三天達(dá)到了高峰。到第七天時,受損的斑馬魚大腦與健康斑馬魚大腦之間不再存在明顯差異。進(jìn)一步的免疫組化實驗結(jié)果表明RG能夠分化產(chǎn)生新生神經(jīng)元,修復(fù)大腦視頂蓋的損傷。“通過分子機(jī)制方面的研究,我們發(fā)現(xiàn)Wnt信號對于調(diào)節(jié)RG的分化與新生神經(jīng)元的再生十分關(guān)鍵”。





